如何做好細胞克隆形成
(一)實驗目的
通過細胞在細胞培養板上的克隆形成能力來提示細胞的增殖能力。
(二)實驗原理
克隆形成是測定細胞增殖能力的有效方法之一。單個細胞在體外持續6代以上,其后代所組成的細胞群稱為克隆。這時每個克隆含有50個以上的細胞,大小在0.3-1.0 mm之間,通過計數克隆形成率,可對單個細胞的增殖潛力做定量分析,了解細胞的增殖能力和獨立生存能力。
(三)實驗流程
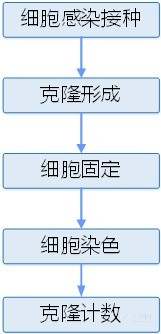
(四) 實驗材料
生物安全柜、熒光顯微鏡、離心機、倒置顯微鏡、CO2培養箱;
完全培養基、胰酶、PBS、結晶紫、4%多聚甲醛。
(五)實驗步驟
1. 準備感染后細胞[如果是克隆形成預實驗,直接用空細胞進行實驗] :將處于對數生長期的各實驗組細胞胰酶消化,完全培養基重懸,制成細胞懸液,計數。
吸棄培養基

PBS清洗

加入胰酶

終止消化

收集細胞

離心獲取沉淀

細胞計數
2. 細胞接種:于6孔板培養板中各實驗組接種500-1000個細胞/孔[正常增殖速度為1:5-1:10傳代,3天長滿細胞,可以接種500個細胞,其余增殖緩慢細胞,可以接種800-1000;接種時注意梯度稀釋細胞懸液,觀察細胞密度,以免因計數不準確導致實驗結果偏差] ,每個實驗組設3個復孔,培養基為含30%FBS的完全培養基;
鋪板

鋪板后搖勻
3. 將接種好的細胞搖勻后輕放于培養箱中繼續培養,每隔3 天進行換液并觀察細胞狀態,顯微鏡下觀察克隆大小[3復孔之間克隆大小應相似] ,待單個克隆生長到大小不超過圖片視野時可以進行拍照;
4. 拍完照之后的將6孔板放入培養箱中繼續培養,待孔中大多數單個克隆中細胞數大于50為止,棄上清,PBS洗滌細胞1次。
5. 每孔加入1 mL 4%多聚甲醛[有毒,注意在安全柜中操作] ,4度冰箱固定細胞60 min,PBS洗滌細胞1次。

加入多聚甲醛
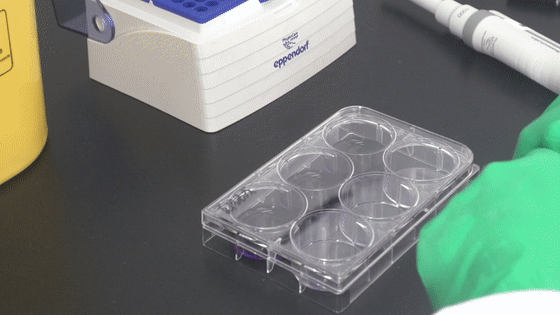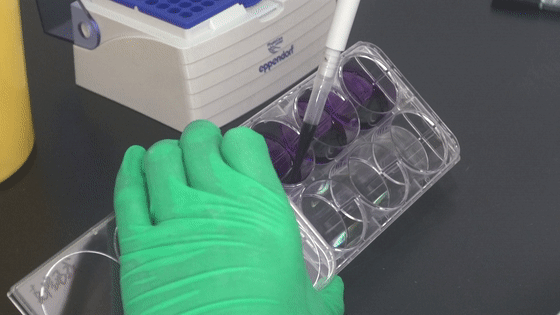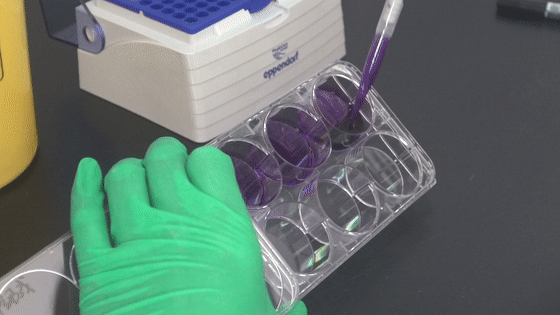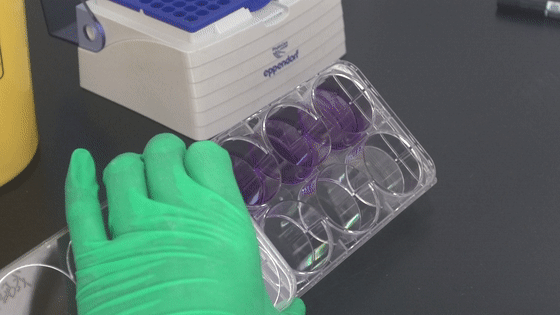
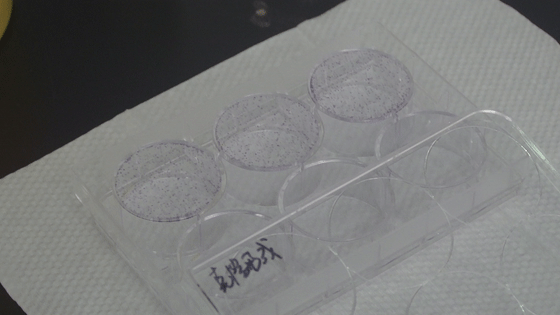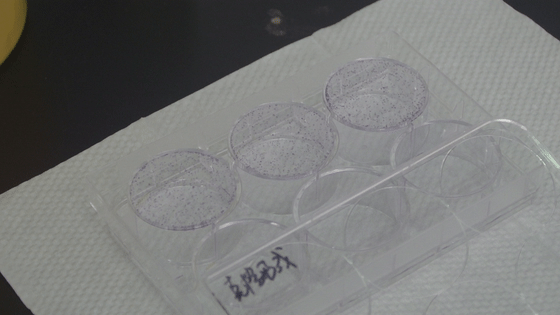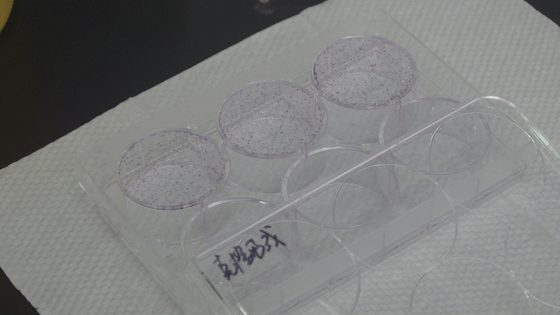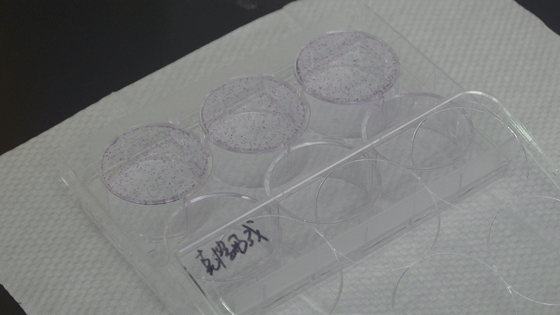
6. 每孔加入潔凈、無雜質結晶紫染液1000 μL,染細胞2min。
7. ddH2O洗滌細胞數次,晾干,數碼相機拍照整,克隆計數。
吸棄染液
加入超純水清洗
晾干

拍攝
(六) 吉凱結果
1. 數碼照相機拍攝結果
2. 熒光顯微鏡拍攝代表性克隆結果
(七) 實驗操作參考文獻
[1] Ruan J. et al. Increased expression of cathepsin L: a novel independent prognostic marker of worse outcome in hepatocellular carcinoma patients. PLoS One. 2014, 9(11):112-136.
[2] Sun R. et al. Down regulation of Thrombospondin2 predicts poor prognosis in patients with gastric cancer. Mol Cancer. 2014, 13:225.
[3] Ma Y. et al. Prostate cancer cell lines under hypoxia exhibit greater stem-like properties. PLoS One. 2011, 6(12):e29170.
[4] Suresh B. et al. Stability and function of mammalian lethal giant larvae-1 oncoprotein are regulated by the scaffolding protein RanBPM. J Biol Chem. 2010, 285(46):35340-9.
[5] Liu JW. et al. ssDNA-binding protein 2 is frequently hypermethylated and suppresses cell growth in human prostate cancer. Clin Cancer Res. 2008, 14(12):3754-60.

