Nature:多能干細胞的“再生”奇跡
多能干細胞(PSCs)能自我更新、自我復制,在人體內有可能分化成幾乎任何類型的細胞,在再生醫學發展方面具有極大潛力。
然而,實現穩定的PSCs制備供應是一項挑戰。2006年,研究人員發現了一種方法,即將成年細胞重新編程為多能狀態,這些誘導的多能干細胞(iPSCs)可以被誘導分化成不同類型的細胞。歷經過去15年的發展,iPSC技術已經成為許多藥物開發工作的基礎,未來可能會改變數百萬人的生活。舉例來說,基于iPSC的療法可以替換帕金森病中死亡的神經元、因黃斑變性而受損的視網膜組織,或者可以免除心臟移植的需要。
拜耳旗下總部位于美國馬薩諸塞州的生物技術公司BlueRock Therapeutics首席執行官Seth Ettenberg表示:“這是一種完全不同的看待藥物的方式——替代病變細胞而不是向它們給藥。我們正朝著這個方向邁進。這絕對是iPSC領域激動人心的時刻。”
2021年6月,拜耳旗下一家總部位于美國馬薩諸塞州的生物技術公司BlueRock Therapeutics啟動了多能干細胞療法DA01用于帕金森病患者的開放標簽I期臨床試驗,并在7月獲得美國FDA授予快速通道資格認定。BlueRock首席執行官Seth Ettenberg表示:“這是一種完全不同的看待藥物的方式——替代病變細胞而不是向它們給藥。我們正朝著這個方向邁進。這絕對是iPSC領域激動人心的時刻。”
然而PSC還有幾個問題尚待解決,比如從哪里獲得細胞。同種異體方法使用來源于健康供體血細胞、批量生產的iPSCs,以提供可普遍使用的療法。然而,這些細胞在移植時通常會產生免疫反應。另一種方法是從患者自身的細胞生成iPSC,但這種自體方法需要更長的時間,成本更高。對于這兩種方法,問題還在于如何遞送iPSC衍生細胞,以及如何確保它們存活和發揮功能。
研究人員正嘗試借助基因編輯等工具解決這些問題,并使基于iPSC的治療更加有效。過去幾年,iPSC在針對3種常見疾病的開發應用方面取得了重大進展。
心血管疾病
心血管疾病是發達國家人口的主要死亡原因。心臟移植極大地提高了存活率,但供不應求。荷蘭Leiden大學的發育生物學家 Christine Mummery說:“心臟捐獻者嚴重短缺,而且情況正在惡化”。癌癥治療的成功加劇了這一問題。他認為,化療可能對心臟產生負面影響。癌癥治愈的人可能在數年后發展為心力衰竭。
人類的iPSCs可以分化成心肌細胞,這是一種跳動的肌肉細胞,其死亡可能導致心力衰竭。研究表明,將心肌細胞移植到梗死的大鼠心臟時可改善心功能。
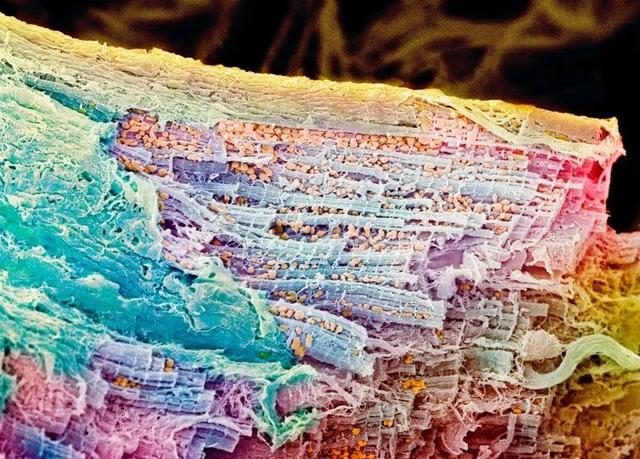
iPSCs可以分化為心肌細胞,但研究人員需要對其進行微調,然后才能在患者身上進行測試(來源:Nature)
但基于iPSC的心血管疾病治療也有一些獨特的挑戰。“其中一個問題是,這些衍生的細胞像胎兒一樣,跳動強烈。它們在移植時會引起心律失常。而隨著細胞成熟,它們又失去了自己的搏動能力,需要一個起搏器。” Mummery說道。
Mummery和她的同事正在開發使分化心臟細胞成熟的方法。她說:“在剛開始研究時,我們的心肌細胞與妊娠16周后的人類胎兒心肌細胞相似。我們現在能做到的是讓它們像出生后幼兒的心肌細胞,不過它們還沒有完全成熟。”
總體而言,基于iPSC的心臟病模型發展最快。通過工程化心臟細胞片或直接對其他心臟細胞重新編程的療法開發仍處于臨床前或非常早期的臨床階段,距離常規臨床使用尚需時日。但是面對如此巨大的醫療需求,再生醫學能提供很多機會。
帕金森病
帕金森病是一種神經退行性疾病,影響全球1000多萬人,其特征是產生多巴胺的中腦神經元進行性喪失,從而導致震顫和其他運動及神經癥狀。當前主流療法可以緩解癥狀,但不能阻止疾病進展。
研究人員希望iPSC療法能夠替換帕金森病進展過程中死亡的神經元。研究顯示,在帕金森病大鼠模型中,iPSC衍生的產生多巴胺的神經元可以改善大鼠行為。此外,在一例帕金森病患者中,自體iPSC衍生的多巴胺細胞在移植18–24個月后,顯示可以穩定或甚至輕微改善了運動癥狀。
然而,大腦是一個難以到達的器官。拜耳iPSC平臺策略副總監Stefan Frank表示:“細胞將通過神經外科手術,使用確保細胞在遞送過程中不會受損的設備注入中腦。然后,細胞將會留在那里,存活并融合。”
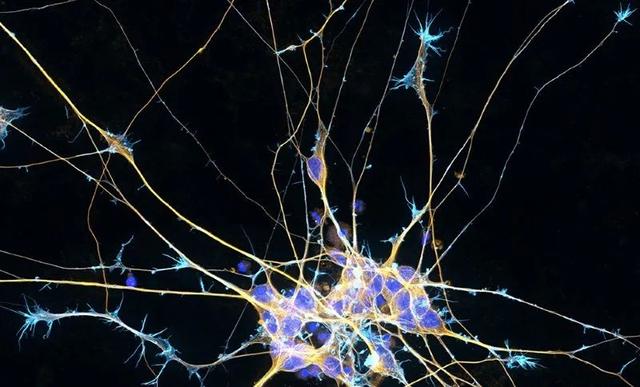
源于干細胞的神經元有可能替換那些因帕金森病而喪失的神經元。但遞送細胞,并確保它們存活和融合,仍然存在巨大的挑戰(來源:Nature)
多能干細胞的遞送和存活正是拜耳旗下Asklepios BioPharmaceutical公司的專長。該公司正在開發病毒載體,將基因片段導入中腦。其中一個基因編碼GDNF,它是一種促進產生多巴胺的神經元存活的生長因子。動物模型研究表明,將GDNF遞送到中腦可改善人類干細胞源性神經元的融合。 與此同時,BlueRock正在進行PSC衍生中腦多巴胺能神經元的臨床試驗。2022年1月初,BlueRock宣布其針對晚期帕金森病患者多能干細胞衍生的多巴胺能神經元開放標簽I期臨床試驗兩組中的第一組已經完成。第一組中的患者接受了雙側手術,將多巴胺能神經元移植到其中腦區域。目前所有入組的患者中均未觀察到嚴重的不良事件。
Ettenberg說:“帕金森病尚無法治愈。我們研發討論替代喪失的細胞以恢復神經回路功能的療法。如果成功,這種方法將使患者免于震顫和其他與帕金森病相關的問題,預示著針對癥狀治療的結束。”
黃斑變性
目前一項最領先的再生療法正被于治療年齡相關的黃斑變性(AMD)。AMD的一個關鍵問題是視網膜色素上皮的進行性喪失,這是一層保護和調節感光細胞的細胞。AMD主要影響65歲以上的人群,全球近9%的失明因此發生。
特別是濕性AMD,其與血管內皮生長因子(VEGF)的過度產生有關,導致視網膜血管的異常生長和滲漏。雖然這種疾病可以通過注射抗VEGF藥物來治療,但這并不能阻止潛在的變性。如果停止治療,復發是很常見的。
相對于大腦,眼睛更容易通過外科手術進入。與大腦一樣的是,眼睛也是免疫豁免的器官,其局部免疫系統不太可能攻擊外來細胞或組織。此外,成年哺乳動物的視網膜保留了一些再生能力,這增加了從固有的祖細胞中長出新細胞的希望。然而,盡管進行了十多年的研究,開發治療AMD的細胞療法依然艱難。
2017年,日本理化學研究所RIKEN的眼科專家和干細胞研究者Masayo Takahashi及其團隊報告,從iPSCs分化而來的患者源性視網膜色素上皮細胞在植入兩例患者后存活了一年。

再生醫學的目標之一是替換在黃斑變性中喪失的視網膜細胞(來源:Nature)
當涉及到使用同種異體材料時,Takahashi的團隊會謹慎地選擇治療對象。他們尋找免疫系統與所用療法細胞系相匹配的患者。她說:“這種人類白細胞抗原(HLA)基因與17%的日本人口相匹配,他們可以在沒有任何免疫抑制的情況下用這種單細胞系進行治療。”
下一代療法的多能潛力
iPSC療法的治療前景遠不只以上這幾種疾病,該領域的初創公司和制藥巨頭正在嘗試進一步技術優化組合。
以拜耳為例,其將iPSC技術、基因編輯及病毒遞送策略整合在公司2020年成立的細胞和基因治療平臺下。該平臺旨在開發突破性創新療法以強化公司在再生醫學領域的戰略地位。
與此同時,拜耳公司的研究人員正在開發基因回路,以精確地設計iPSC,使其能夠感知周圍的特定疾病標記并作出響應。
此外,拜耳旗下BlueRock公司聯手拜耳飛躍計劃所投資支持的Senti Biosciences,共同開發“可誘導的基因開關”,旨在使細胞能夠感知環境,并且只有在滿足特定條件時才能行動。Ettenberg說:“CRISPR基因編輯技術讓我們可以實現修改細胞的基因組以提高移植時的治療潛力,或者允許患者耐受來自外源供體的細胞。”
至于自體細胞和異體細胞之爭,這依然是一個懸而未決的問題,涉及免疫排斥風險、時間與成本等因素之間的權衡。但也可能無需只選擇其中一種。Frank表示:“這兩種方式很可能共存。正如個體化醫療的許多方面一樣,為每個患者個體選擇正確的方法才是正解。”
參考資料:
New cells for old: The emerging potential of pluripotent stemcells in regenerative medicine(來源:Nature)
免責聲明:內容來源于網絡,版權歸原作者所有。本文僅作信息交流之目的,文中觀點不代表本網站觀點。如涉及版權問題,請及時聯系我們刪除。

