【科普】基礎(chǔ)的細(xì)胞實驗
1.體外培養(yǎng)細(xì)胞一代生存期
? 分為游離期、貼壁期、潛伏期、對數(shù)生長期、停止期(平臺期)。
? 對數(shù)生長期:細(xì)胞數(shù)隨時間變化成倍增長,活力最佳,細(xì)胞數(shù)量呈指數(shù)增長,細(xì)胞群體均一。最適合進行實驗研究。
? 細(xì)胞搖勻的經(jīng)驗:
孔越小,越要好好搖。種的時候可以有意識的分散種細(xì)胞,而不是直接一個小區(qū)域種下去。96孔板種細(xì)胞輕點打進孔里,打的太猛細(xì)胞容易聚集在邊緣。六孔板手動8字晃勻效果比較好。種細(xì)胞時晃動細(xì)胞很重要,但應(yīng)避免在桌子上推著前后左右晃。在手中兩個方向的八字晃會更穩(wěn)更好。
2. 細(xì)胞計數(shù)
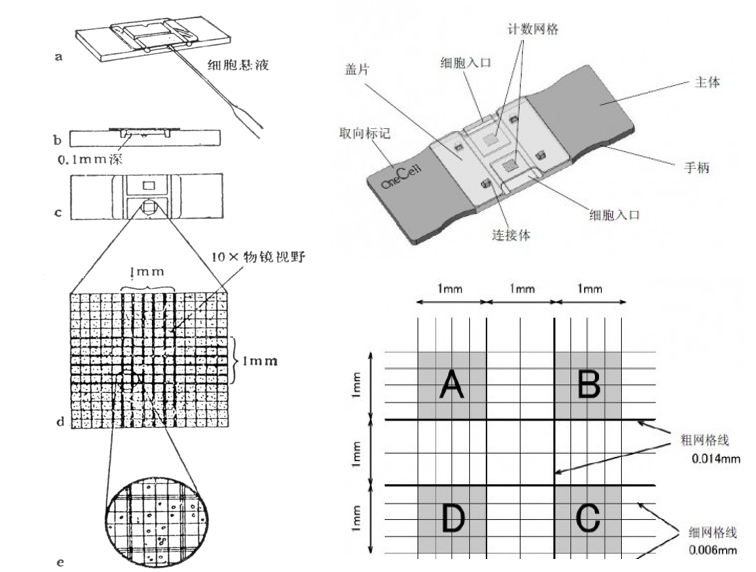
? 細(xì)胞懸液的細(xì)胞數(shù)/ml=(四個大格子細(xì)胞數(shù)/4) ×稀釋倍數(shù) ×104/ml
? 計數(shù)建議:
1) 壓邊線細(xì)胞:計上不計下,計左不計右;
2) 鏡下偶見有兩個以上細(xì)胞組成的細(xì)胞團,應(yīng)按單個細(xì)胞計算,若細(xì)胞團10%以上,說明分散不好,需重新制備細(xì)胞懸液;
3) 每個細(xì)胞懸液至少滴樣兩次求平均值。
? 提問:細(xì)胞計數(shù)的濃度控制在多少?計數(shù)重復(fù)幾次?
答:建議濃度控制在50-100萬/ml。建議表型實驗計數(shù)4次,普通實驗計數(shù)2次。建議全部計數(shù)完再一起種板。
? 注意點:細(xì)胞計數(shù)不要同時記超過4株以上的細(xì)胞。若有需要,先消化記4株,細(xì)胞濃度調(diào)好靜置一邊;再消化計另外的。而后按消化和計數(shù)順序種細(xì)胞。這樣可以避免多株細(xì)胞同時消化而帶來的消化不理想。
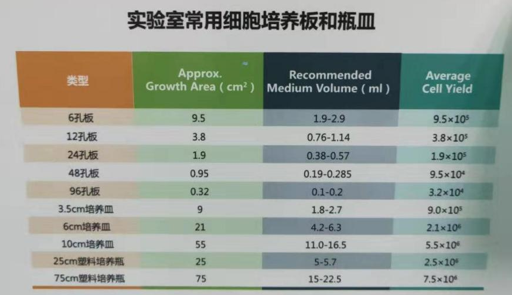
3. 常用細(xì)胞培養(yǎng)器皿
4. 液氮是低溫制品,在使用過程中要防止凍傷。在液氮中操作及存取冷凍物品時速度要快,要注意輕拿輕放,以免內(nèi)容物解凍,造成不必要的損失。
5. 細(xì)胞傳代
? 消化溫度:室溫或37℃。
? 消化時間:不超過10 min,也不可太短(須形成單細(xì)胞懸液)。
? 注意點:
1) 防止細(xì)胞成片滑落(4℃消化,延長消化時間較易獲得單細(xì)胞懸液);
2) 輕柔吹打,防止機械損傷;
3) 離心時不超過300 g (1000 rpm),實驗室目前離心所用轉(zhuǎn)速為800rpm;
4) 盡量避免刮傷培養(yǎng)瓶細(xì)胞貼附面,否則影響觀察且細(xì)胞貼壁不均勻;
5) 及時換液和傳代,不可拖延,避免細(xì)胞過爆后細(xì)胞狀態(tài)不好。
6. 細(xì)胞消化條件參考
Cell line | 胰酶 | 條件 | 時間 | 傳代比例 | 長滿時間 | 10cm dish細(xì)胞數(shù) |
Huh1 | EPET | 37℃ | 4 min | 1:4 | 5d | 400w |
Huh7 | EPET | 37℃ | 2 min | 1:6 | 4d | 200w |
HLE | EPET | 37℃ | 3 min | 1:8 | 3d | 200w |
HLF | EPET | 37℃ | 3 min | 1:8 | 3d | 200w |
HepG2 | 0.25%Trypsin | 37℃ | 4 min | 1:3 | 5d | 200w |
Hep3B | 0.25%Trypsin | 37℃ | 1.5 min | 1:4 | 4d | - |
HUCCT1 | 0.25%Trypsin | 37℃ | 6 min | 1:10 | 3d | 500w |
RBE | EPET | 37℃ | 2 min | 1:10 | 3d | 200-300w |
Huh28 | 0.25%Trypsin | 37℃ | 6 min | 1:3 | 3d | 30w |
293T | 1/10 EPET | RT | 1 min | 1:20 | 3d | 1000w |
3T3 | EPET | 37℃ | 3 min | 1:8 | 3d | 400w |
LX2 | EPET | RT | 1 min | 1:3-1:4 | 2-3d | - |
THP1 | - | - | - | 1:4 | 3 | - |
7. 換液時機
1) pH降低。培養(yǎng)基顏色由紅變橙要警惕,變成黃色前一定要換液。
pH降至6.5時,細(xì)胞停止生長。
pH降至6.0時,細(xì)胞失去活性。
2) 發(fā)現(xiàn)細(xì)胞出現(xiàn)形態(tài)衰退時須勤換液。
3) 細(xì)胞密度過低或生長緩慢,則更換一半培養(yǎng)基。
8. 細(xì)胞凍存(慢凍)
? 預(yù)先配制凍存液:10%DMSO +細(xì)胞生長液(50%血清+40%基礎(chǔ)培養(yǎng)液)。
由于DMSO 稀釋時會放出大量熱能,故不可將DMSO直接加入細(xì)胞液中,必須使用前先行配制完成。
? 取對數(shù)生長期細(xì)胞,經(jīng)胰酶消化后,加入適量凍存液, 用吸管吹打制成細(xì)胞懸液(1-5×106 cell/ml)
? 加1 ml細(xì)胞懸液于凍存管中,密封后標(biāo)記冷凍細(xì)胞名稱、冷凍日期、代數(shù)、細(xì)胞數(shù)量和實驗者名字。液氮長期保存。
? 慢凍程序:
1) 標(biāo)準(zhǔn)程序:采用細(xì)胞凍存器。
當(dāng)溫度在-25℃以上時, 1~2 ℃/min
當(dāng)溫度達-25℃以下時, 5~10 ℃/min
當(dāng)溫度達-100℃時,可迅速放入液氮中
2) 傳統(tǒng)程序:冷凍管置于4℃ 1 h→ -20℃ 1 h→ -80℃16-18 h(或隔夜) → 液氮槽長期儲存。
9. 細(xì)胞的復(fù)蘇方法(速融)
? 注意點:37℃水浴,快速解凍,避免慢速融化水分滲入細(xì)胞內(nèi),再次形成胞內(nèi)結(jié)晶損傷細(xì)胞。
? 凍存細(xì)胞從液氮中取出后,立即放入37℃水浴中,輕輕搖動冷凍管,使其在1 min內(nèi)(不要超過3 min)全部融化,5 min內(nèi)用培養(yǎng)液稀釋至原體積的10倍以上。
? 兩種解凍后處理方法:
1) 解凍后的細(xì)胞直接接種到含完全生長培養(yǎng)液的細(xì)胞培養(yǎng)皿進行培養(yǎng),24 h后更換培養(yǎng)液,以去除DMSO。
2) 解凍后的細(xì)胞先通過低速離心10 min去除冷凍保護劑,然后再接種到含完全生長培養(yǎng)液的培養(yǎng)皿中。
10. 熒光顯微鏡啟動高壓汞燈后,不得在30 min內(nèi)將其關(guān)閉;關(guān)閉后,必須待汞燈冷卻后方可再次打開。
11. Lentivirus production in 293T cells
Using Lipofectamine 3000, Ji lab, 2019
1. The day before transfection (Day 1), passage1/3 10 cm dish 293T cells in a new 10cm dish so that they will be 70-80% confluent on the day of transfection.
2. On the day of transfection (Day 2), remove the culture medium from the 293T cells and replace with 6 ml of fresh medium (without antibiotics) containing serum.
3. For each transfection sample, prepare DNA-Lipoectamine? 3000 complexes as follows:
l In a sterile 1.5 ml tube with 0.5ml Opti-MEM?, add:
Packaging Plasmid--psPAX2 (10703bp, addgene12260) 5.3ug
Envelope Plasmid---pMD2.G (5824bp, addgene12259) 1.4ug
or
Packaging Plasmid--pCMV-dR8.2 dvpr (13457bp, addgene8455) 6.6ug
Envelope Plasmid---pCMV-VSV-G (6363bp, addgene8454) 1.6ug
AND
Transfer Plasmid---Lenti-miR/miRZip-antimiR (SBI, 7.5/7.9kb) 5.3ug
Note:The proper molar ratio shall be Envelope Plasmid:Packaging Plasmid:Transfer Plasmid=1:2:3~4.
l Adding p3000. p3000 (volume): plasmid (ug) =2:1
l Mix gently, RT for 5 mins.
4. In a separate sterile 1.5 ml tube with 0.5ml Opti-MEM?, add: Lipofectamine? 3000 20ul.
Mix gently, RT for 3-5 mins (Note: has to be less than 15mins)
5. After the incubation, combine the above diluted DNA with the diluted Lipofectamine? 3000.
Mix gently. Incubate, RT for 20 minutes.
6. Add the DNA-Lipofectamine?3000 complexes to each dish of cells. Mix gently by rocking the plate back and forth.
7. After 24 hours post transfection (Day 3), add 8 ml fresh medium (without antibiotics) containing serum. Incubate at 37°C in a humidified 5% CO2 incubator.
8. Harvest virus-containing supernatants 52hours posttransfection (Day 4) by removing medium into to a 15 ml sterile tube, keep on ice.
9. Centrifuge supernatants at 2000 rpm for 10 minutes at +4°C to pellet debris.
10. Filter the viral supernatants through a 0.45 μm filter.
11. Aliquot viral supernatants into 1.5 ml tubes (0.5ml/tube). Store viral stocks at -80°C.
12. Proceed to Titer Your Viral Stock.
Note: If use lipo 2000, no need add p3000. If use PEI 40,000, PEI: plasmid=1.875: 1
12. Titer LentiVirus
Viacounting GFPcells, Ji lab, 2016
1. The day before transduction (Day 1), trypsinize and count the 3T3 cells, plating 3000 cells/well of 96-well plate. Incubate cells at 37°C overnight in a humidified 5% CO2 incubator.
2. On the day of transduction (Day 2), thaw your Lentiviral stock and prepare 10-fold serial dilutions ranging from 10-1 to 10-8. For each dilution, dilute the Lentiviral stock into complete culture medium to a final volume of 0.15 ml. DO NOT vortex, But mix well.
l Using 96-well plate to do the dilution and tittering.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
A | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
B | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
C | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
D | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
E | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
F | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
G | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
H | D | D | D | D | D | D | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 | 3T3 |
l Column #1-#6 is used for dilution.
l Add 135 ul of culture medium to each dilution well.
l Line A: add 15 ul virus from original lentivirus stock. Mix well
l Line B: add 15 ul virus from the well of line A. Mix well
l Line C: add 15 ul virus from the well of line B. Mix well
l ……
l So, line A is 10× dilution; line B is 100× dilution.
3. Remove the culture medium from the cells. Mix each dilution gently by pipetting and add 0.1 ml to one well of cells (total volume = 0.1 ml).
4. Add Polybrene? to each well to a final concentration of 8 μg/ml.
5. Swirl the plate gently to mix. Incubate at 37°C overnight in a humidified 5% CO2 incubator.
6. The following day (Day 3), remove the media containing virus and replace with 0.1 ml of complete culture medium. Incubate at 37°C overnight in a humidified 5% CO2 incubator.
7. Incubate cells for an additional 3 days. Analyze the percentage of GFP-positive cells.
8. Calculate the titer (TU/ml) by with the formula:
Titer = # of positive clones / 0.1ml × times of dilution
13. 腺相關(guān)病毒(Adeno-Associated Viral Vector,AAV)
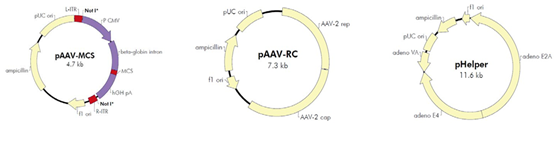
腺相關(guān)病毒屬微小病毒科(parvovirus),為無包膜的單鏈線狀 DNA 病毒。AAV 的基因組約4700bp,包括上下游兩個開放讀碼框架(ORF),位于分別由 145 個核苷酸組成的2 個反向末端重復(fù)序列(ITR)之間。
基因組中有 3 個啟動子(P5、P19 和 P40) 和 2 個開放閱讀讀框(ORF),rep 和 cap,如圖所示。rep 編碼 4 個重疊的多功能蛋白,即 Rep78、Rep68、Rep52 和 Rep40,其中 Rep78 與 Rep68 參與 AAV 的復(fù)制與整合,Rep52 和 Rep40 具有解螺旋酶和 ATP 酶活性,與 Rep78、Rep68 共同參與單鏈基因組的復(fù)制;cap 編碼的 VP1、 VP2、VP3是裝配成完整病毒所需要的衣殼蛋白,它們在 AAV 病毒整合、復(fù)制和裝配中其重要作用。
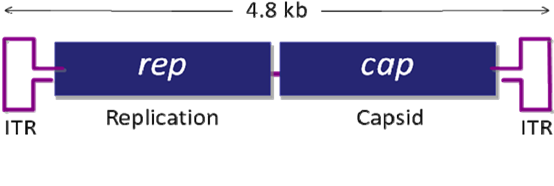
From腺相關(guān)病毒操作手冊
14. 重組腺相關(guān)病毒載體系統(tǒng)簡介
AAV是一種復(fù)制缺陷型微小病毒,其增殖復(fù)制需要腺病毒或皰疹病毒的輔助。
AAV無輔助病毒系統(tǒng)(AAV Helper-Free System),可以在無輔助病毒的條件下生產(chǎn)出重組腺相關(guān)病毒。生產(chǎn)具有感染性的AAV 病毒顆粒所需的腺病毒基因產(chǎn)物(如:E2A,E4 等基因)大部分由pHelper 質(zhì)粒提供。
腺病毒基因產(chǎn)物由穩(wěn)定表達腺病毒E1基因的AAV-293宿主細(xì)胞提供。AAV-293細(xì)胞是HEK293細(xì)胞經(jīng)過改良腺相關(guān)病毒生產(chǎn)能力而衍生出的亞克隆細(xì)胞系。
rep和cap基因從病毒載體中被轉(zhuǎn)移到輔助質(zhì)粒pAAV-RC 中,AAV ITRs 仍位于病毒載體中。在輔助質(zhì)粒的幫助下,僅需兩端的ITR就能將攜帶的外源片段包裝進入腺相關(guān)病毒顆粒。
? AAV可以特異地只感染肝臟或者其他器官,不同血清型AAV對不同組織親和度不同,如AAV8對肝臟組織親和度最高。
? AAV不整合在基因組上,降解較慢,大約能在體內(nèi)保持6個月以上,一般不需要重復(fù)給AAV,根據(jù)實驗具體考慮。
? AAV最長可插入片段參考: